Nắm vững nội năng và sự biến thiên nội năng để đạt điểm cao!
Chào mừng bạn đến với vatly.edu.vn, nơi chia sẻ kiến thức vật lý sâu rộng và dễ hiểu. Hôm nay, chúng ta sẽ cùng tìm hiểu về nội năng và sự biến thiên nội năng, khái niệm không chỉ quan trọng trong sách giáo khoa mà còn trong ứng dụng thực tiễn, từ công nghệ đến đời sống hàng ngày.
Chào mừng bạn đến với vatly.edu.vn, nơi chia sẻ kiến thức vật lý sâu rộng và dễ hiểu. Hôm nay, chúng ta sẽ cùng tìm hiểu về nội năng và sự biến thiên nội năng, khái niệm không chỉ quan trọng trong sách giáo khoa mà còn trong ứng dụng thực tiễn, từ công nghệ đến đời sống hàng ngày.
Nội năng
Nội năng là gì?
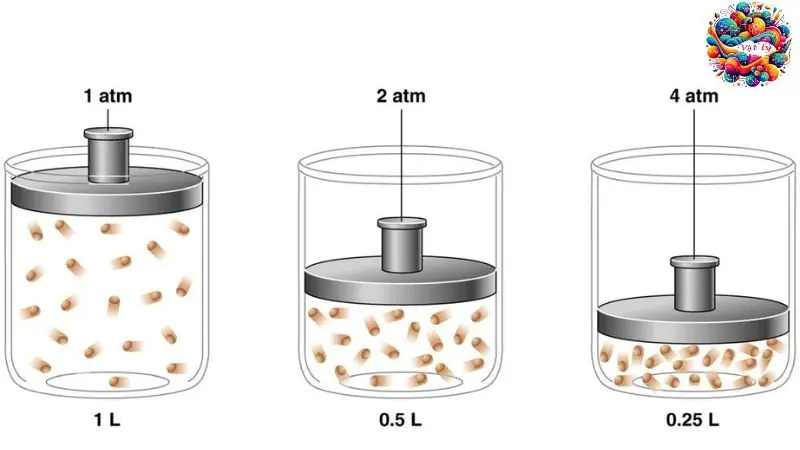
Nội năng là một đại lượng thể hiện khả năng thực hiện công của một hệ thống. Nó bao gồm năng lượng nhiệt (do chuyển động hỗn độn của các phân tử) và năng lượng liên kết (năng lượng liên kết giữa các nguyên tử trong phân tử, năng lượng liên kết giữa các phân tử).
Kí hiệu: U
Đơn vị: Joule (J)
Công thức:
Nội năng được xem là một hàm của nhiệt độ và thể tích, thể hiện qua mối quan hệ:
\[ U = f(T, V) \]
Ở đây, \( f \) chỉ một hàm toán học mà qua đó nội năng \( U \) của hệ thống có thể được tính toán dựa trên nhiệt độ \( T \) và thể tích \( V \) của hệ. Hàm này có thể khác nhau tùy thuộc vào bản chất cụ thể của hệ thống và các phần tử cấu thành nên nó, cũng như các điều kiện áp dụng cho hệ.
Độ biến thiên nội năng
Độ biến thiên nội năng là phần nội năng tăng thêm hay giảm bớt đi trong một quá trình. Ký hiệu của độ biến thiên nội năng là ΔU.
Các cách làm thay đổi nội năng
Nội năng của một hệ thống có thể thay đổi thông qua hai phương thức cơ bản: trao đổi nhiệt và thực hiện công. Dưới đây là cách thay đổi nội năng của một hệ thống:
Trao đổi nhiệt
Trao đổi nhiệt là quá trình truyền năng lượng dưới dạng nhiệt từ một hệ thống này sang hệ thống khác hoặc từ hệ thống sang môi trường xung quanh (hoặc ngược lại).
- Khi một hệ thống hấp thụ nhiệt từ môi trường xung quanh, nội năng của nó tăng lên. Điều này thường xảy ra khi hệ thống nằm trong môi trường có nhiệt độ cao hơn.
- Ngược lại, khi hệ thống tỏa nhiệt ra môi trường, nội năng của nó giảm đi. Điều này xảy ra khi hệ thống nóng hơn môi trường xung quanh.
Thực hiện công
Công là quá trình truyền năng lượng thông qua sự dịch chuyển hay biến dạng của một hệ thống dưới tác dụng của một lực.
- Khi một hệ thống thực hiện công lên môi trường xung quanh (ví dụ: khi khí trong xi-lanh đẩy piston ra ngoài), nội năng của hệ thống giảm đi.
- Ngược lại, khi môi trường thực hiện công lên hệ thống (ví dụ: nén khí trong xi-lanh), nội năng của hệ thống tăng lên.
Biến thiên nội năng của một hệ thống (\(\Delta U\)) có thể được tính bằng tổng nhiệt lượng truyền vào hệ thống và công thực hiện bởi hệ thống:
\[ \Delta U = Q \]
trong đó:
– \( \Delta U \) là sự biến thiên nội năng.
– \( Q \) là nhiệt lượng truyền vào hệ thống (nếu hệ thống tỏa nhiệt ra môi trường, \( Q \) sẽ có giá trị âm).
Bài tập bổ sung về nội năng

Ví dụ 1: Một lượng khí lí tưởng chứa trong một xi-lanh được nén đẳng nhiệt từ thể tích 4.0 L xuống còn 2.0 L ở nhiệt độ 300 K. Hãy tính sự biến thiên nội năng của khí, biết rằng khí đó là khí heli (He) và coi như một khí đơn nguyên tử.
Lời giải
Đối với quá trình đẳng nhiệt (nhiệt độ không đổi), sự biến thiên nội năng (\(\Delta U\)) của một khí đơn nguyên tử như heli được tính bằng công thức:
\[ \Delta U = \frac{3}{2} nR\Delta T \]
Tuy nhiên, do quá trình là đẳng nhiệt, \(\Delta T = 0\), do đó \(\Delta U = 0\). Điều này có nghĩa là sự biến thiên nội năng của khí heli trong quá trình nén đẳng nhiệt là 0.
Giải thích
– Quá trình đẳng nhiệt có nghĩa là nhiệt độ của hệ thống được giữ không đổi. Do đó, không có sự biến thiên nhiệt độ (\(\Delta T = 0\)).
– Vì nội năng (\(U\)) của một khí lí tưởng chỉ phụ thuộc vào nhiệt độ và không phụ thuộc vào áp suất hay thể tích, sự biến thiên nhiệt độ bằng không dẫn đến sự biến thiên nội năng cũng bằng không.
– Mặc dù thể tích của khí thay đổi, nhưng do quá trình đẳng nhiệt, năng lượng mà hệ thống nhận được thông qua công làm việc được bù đắp bởi năng lượng mất đi qua trao đổi nhiệt với môi trường, vì vậy tổng nội năng không thay đổi.
Kết luận: Trong quá trình nén đẳng nhiệt của khí heli, sự biến thiên nội năng của khí là 0, dù thể tích của khí có thay đổi.
Ví dụ 2: Một bình kín chứa 1 mol khí nitơ (N₂) ở nhiệt độ ban đầu 27°C. Khí sau đó được đun nóng đẳng áp cho đến khi nhiệt độ tăng lên đến 127°C. Hãy tính sự biến thiên nội năng của khí, biết rằng khí nitơ có thể coi như một khí đa nguyên tử với \( f = 5 \) (số bậc tự do của khí đa nguyên tử).
Lời giải
Đối với một khí đa nguyên tử như nitơ, nội năng \( U \) và sự biến thiên nội năng \( \Delta U \) có thể được tính bằng công thức dựa trên số bậc tự do \( f \) và nhiệt độ \( T \):
\[ \Delta U = \frac{f}{2} nR \Delta T \]
trong đó \( n \) là số mol khí, \( R \) là hằng số khí lí tưởng (\( \approx 8.314 \, \text{J/(mol·K)} \)), và \( \Delta T \) là sự biến thiên nhiệt độ tính bằng Kelvin.
Bước 1: Chuyển đổi nhiệt độ từ Celsius sang Kelvin
– Nhiệt độ ban đầu: \( T_1 = 27°C = 300K \) (vì \( 27 + 273 = 300 \))
– Nhiệt độ cuối cùng: \( T_2 = 127°C = 400K \) (vì \( 127 + 273 = 400 \))
Bước 2: Tính \( \Delta T \)
\[ \Delta T = T_2 – T_1 = 400K – 300K = 100K \]
Bước 3: Tính \( \Delta U \)
\[ \Delta U = \frac{5}{2} \times 1 \text{ mol} \times 8.314 \frac{\text{J}}{\text{mol·K}} \times 100K \]
\[ \Delta U = \frac{5}{2} \times 831.4 \, \text{J} \]
\[ \Delta U = 2078.5 \, \text{J} \]
=> Vậy, sự biến thiên nội năng của 1 mol khí nitơ khi nhiệt độ tăng từ 27°C lên 127°C là 2078.5 Joules.
Ví dụ 3: Một lượng khí lý tưởng được giữ trong một xi lanh với pittông di động. Ban đầu, khí có thể tích \( V_1 = 2 \, \text{m}^3 \), nhiệt độ \( T_1 = 300 \, K \). Sau đó, khí được nung nóng đẳng áp cho đến khi thể tích tăng gấp đôi và đạt \( V_2 = 4 \, \text{m}^3 \). Biết rằng nhiệt dung ở áp suất không đổi của khí là \( C_p = 1000 \, J/(kg \cdot K) \) và khối lượng của khí là \( m = 1 \, kg \). Tính sự thay đổi nội năng của khí.
Phân tích:
– Quá trình đẳng áp (áp suất không đổi) khi nung nóng khí.
– Sự thay đổi nội năng (\( \Delta U \)) có thể được tính toán thông qua sự thay đổi nhiệt độ \( \Delta T \).
Lời giải
- Tính nhiệt độ cuối \( T_2 \) sử dụng định luật Gay-Lussac về sự thay đổi thể tích và nhiệt độ ở áp suất không đổi: \( \frac{V_1}{T_1} = \frac{V_2}{T_2} \)
- Sắp xếp lại công thức để tìm \( T_2 \): \( T_2 = \frac{V_2 \times T_1}{V_1} = \frac{4 \, \text{m}^3 \times 300 \, K}{2 \, \text{m}^3} = 600 \, K \)
- Tính sự thay đổi nhiệt độ \( \Delta T = T_2 – T_1 = 600 \, K – 300 \, K = 300 \, K \)
- Sử dụng công thức sự thay đổi nội năng \( \Delta U \) cho quá trình đẳng áp: \( \Delta U = m(C_v \Delta T) \)
- Tìm \( C_v \) từ \( C_p \) sử dụng mối quan hệ \( C_p – C_v = R \), với \( R \) là hằng số khí lý tưởng. Đối với khí lý tưởng, \( R \approx 287 \, J/(kg \cdot K) \).
- Giả sử \( C_v = C_p – R = 1000 \, J/(kg \cdot K) – 287 \, J/(kg \cdot K) = 713 \, J/(kg \cdot K) \)
- Cuối cùng, \( \Delta U = 1 \, kg \times 713 \, J/(kg \cdot K) \times 300 \, K = 213900 \, J \)
=> Sự thay đổi nội năng của khí khi nung nóng đẳng áp từ thể tích \( 2 \, \text{m}^3 \) đến \( 4 \, \text{m}^3 \) và nhiệt độ từ \( 300 \, K \) đến \( 600 \, K \) là \( 213900 \, J \).
Qua bài viết ngắn gọn này, hy vọng bạn đã có cái nhìn rõ ràng về nội năng và cách nó thay đổi trong thế giới vật lý. Nắm vững khái niệm này không chỉ giúp bạn trong học thuật mà còn trong việc ứng dụng vật lý vào giải quyết vấn đề thực tế. Hãy tiếp tục theo dõi vatly.edu.vn để khám phá và cập nhật thêm nhiều kiến thức bổ ích.
Bài Viết Liên Quan
Tôi là Kiều Anh, đam mê khám phá và chia sẻ những kiến thức vật lý thú vị từ cuộc sống hằng ngày đến bài học trên lớp. Với cách viết sinh động và dễ hiểu, tôi mong muốn giúp độc giả thấy được vẻ đẹp của vật lý trong mọi khía cạnh của cuộc sống. Hy vọng những bài viết của tôi trên vatly.edu.vn sẽ truyền cảm hứng và làm giàu thêm kiến thức cho mọi người.







