Mẫu nguyên tử Bo: Giải mã cấu trúc nguyên tử
Chào mừng bạn đến với vatly.edu.vn! Hôm nay, chúng ta sẽ tìm hiểu về mẫu nguyên tử Bo, một trong những mô hình cơ bản nhất của lý thuyết nguyên tử, được đề xuất bởi Niels Bohr. Mẫu này không chỉ làm sáng tỏ cấu trúc của nguyên tử mà còn giúp giải thích các hiện tượng quang phổ, đóng góp vào sự phát triển của vật lý hiện đại.
Chào mừng bạn đến với vatly.edu.vn! Hôm nay, chúng ta sẽ tìm hiểu về mẫu nguyên tử Bo, một trong những mô hình cơ bản nhất của lý thuyết nguyên tử, được đề xuất bởi Niels Bohr. Mẫu này không chỉ làm sáng tỏ cấu trúc của nguyên tử mà còn giúp giải thích các hiện tượng quang phổ, đóng góp vào sự phát triển của vật lý hiện đại.
Khái niệm và nguyên tắc của mẫu nguyên tử Bo
Khái niệm mẫu nguyên tử Bo
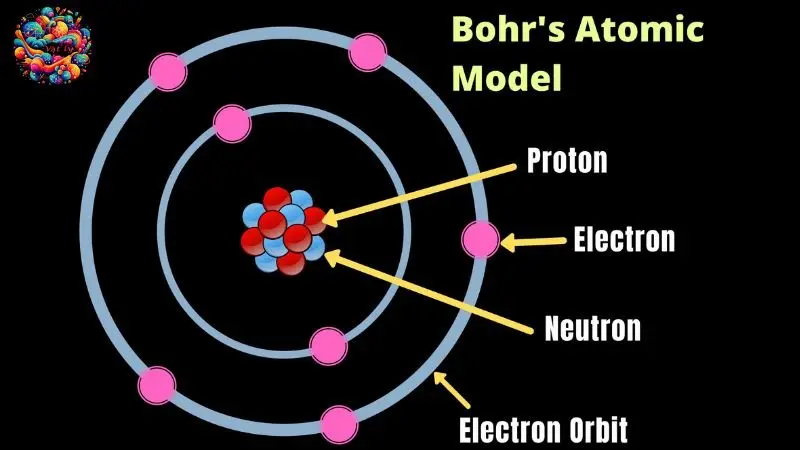
Mẫu nguyên tử Bo thường gây tò mò cho nhiều học sinh về bản chất và nguồn gốc của nó. Đây là một mô hình tinh tế kết hợp giữa mẫu nguyên tử Rutherford và hai tiên đề quan trọng của Bo về trạng thái dừng và sự hấp thụ cũng như bức xạ năng lượng của nguyên tử. Mô hình này còn được biết đến với cái tên “mô hình hành tinh của nguyên tử”.
Nguyên tắc cơ bản của mẫu nguyên tử Rutherford
Vào năm 1911, sau nhiều nghiên cứu, Rutherford đã đề xuất mô hình nguyên tử mà ở đó, hạt nhân mang điện tích dương nằm ở trung tâm, được bao quanh bởi các electron mang điện tích âm chuyển động trên các quỹ đạo tròn hoặc elip, tương tự như hệ thống Mặt Trời.
Tuy nhiên, mẫu này không thể giải thích được hiện tượng quang phổ vạch cũng như đảm bảo tính bền vững của nguyên tử.
Đến năm 1913, Bo đã áp dụng thuyết lượng tử ánh sáng vào mô hình nguyên tử và cải tiến mẫu nguyên tử Rutherford bằng cách đưa vào hai tiên đề của mình. Nhờ đó, mẫu nguyên tử Bo không chỉ giải thích được tính bền vững của nguyên tử mà còn lý giải cách thức tạo thành quang phổ vạch.
Mẫu nguyên tử Bo vẫn giữ được cấu trúc cơ bản của mẫu hành tinh nguyên tử, nhưng đã được bổ sung và hoàn thiện hơn, và đến nay vẫn là một phần không thể thiếu trong lý thuyết vật lý hiện đại.
Tiên đề của Bo về cấu trúc nguyên tử
Các trạng thái dừng
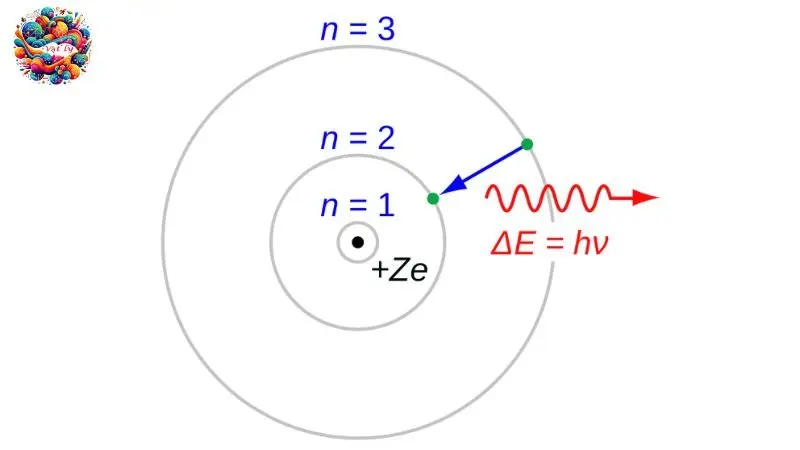
Theo Niels Bohr, một nguyên tử có thể tồn tại ổn định chỉ trong những trạng thái có mức năng lượng cụ thể, được gọi là trạng thái dừng. Trong các trạng thái này, nguyên tử không phát ra bức xạ.
Trạng thái cơ bản, với n = 1, là trạng thái dừng có mức năng lượng thấp nhất. Khi nguyên tử hấp thụ năng lượng, nó chuyển lên các trạng thái kích thích cao hơn, ví dụ như trạng thái thứ n (n > 1).
Trong các trạng thái dừng này, electron di chuyển trên những quỹ đạo có bán kính cụ thể rn, được gọi là quỹ đạo dừng, với công thức tính bán kính Bo rn = n²r0, trong đó r0 = 5.3 x 10^-11 mét.
Sự bức xạ và hấp thụ năng lượng
Khi một nguyên tử chuyển từ trạng thái dừng năng lượng cao Em xuống trạng thái dừng năng lượng thấp hơn En, nó phát ra một photon có năng lượng bằng chênh lệch năng lượng giữa hai trạng thái đó, tức Em – En = hfnm, với h là hằng số Planck và fnm là tần số của photon.
Ngược lại, khi một nguyên tử trong trạng thái dừng năng lượng thấp En hấp thụ một photon có năng lượng hf bằng chênh lệch năng lượng Em – En, nguyên tử sẽ chuyển lên trạng thái dừng cao hơn En. Điều này dẫn đến một tính chất đặc biệt: khi nguyên tử hấp thụ ánh sáng ở một bước sóng nhất định, nó cũng sẽ phát ra ánh sáng ở bước sóng đó khi chuyển trạng thái.
Khái niệm quang phổ phát xạ và hấp thụ của nguyên tử hydro
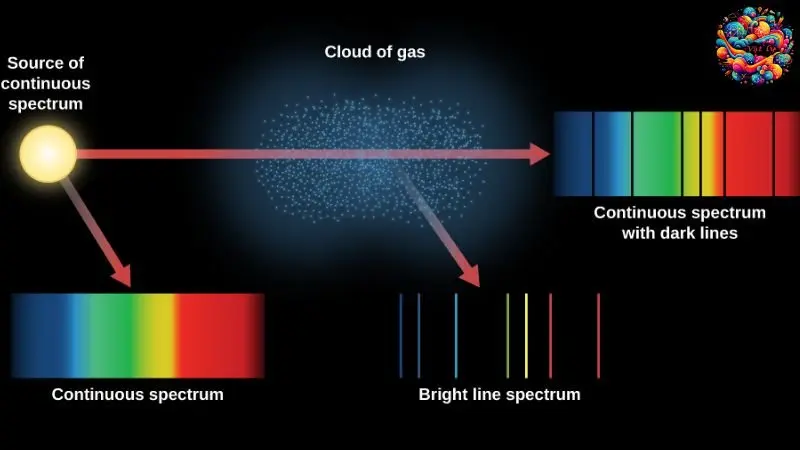
Sau khi nghiên cứu mẫu nguyên tử Bo, học sinh sẽ có cái nhìn sâu sắc hơn về cách thức tạo ra quang phổ phát xạ và quá trình hấp thụ của nguyên tử Hydro. Quá trình này bắt đầu khi một electron trong nguyên tử Hydro chuyển từ một mức năng lượng cao (Ecao) xuống một mức năng lượng thấp hơn (Ethấp), trong quá trình này, một photon được phát ra. Năng lượng của photon này được xác định chính xác bởi công thức hf = Ecao – Ethấp, trong đó h là hằng số Planck và f là tần số của photon.
Photon này tạo ra ánh sáng đơn sắc, và bước sóng của ánh sáng này, λ, được tính bằng công thức λ = c/f, với c là tốc độ ánh sáng. Điều này tương ứng với một vạch quang phổ đơn sắc, đặc trưng cho Hydro.
Trong trường hợp của quang phổ hấp thụ, khi nguyên tử Hydro ở trạng thái năng lượng thấp được chiếu sáng bởi ánh sáng trắng – bao gồm các photon với nhiều mức năng lượng khác nhau – nó sẽ hấp thụ photon có năng lượng chính xác ε = Ecao – Ethấp để chuyển lên mức năng lượng cao.
Điều này làm cho một bước sóng đơn sắc bị hấp thụ, dẫn đến sự xuất hiện của vạch tối trên quang phổ liên tục. Vì thế, quang phổ hấp thụ của nguyên tử Hydro cũng là một loại quang phổ vạch, tương tự như quang phổ phát xạ.
Bài tập ứng dụng về mẫu nguyên tử Bo có đáp án

Câu 1. Phát biểu nào sau đây là đúng về mẫu nguyên tử Bo?
A. Electron chuyển động ngẫu nhiên trong nguyên tử.
B. Electron chuyển động trên các quỹ đạo dừng có bán kính xác định.
C. Electron có thể chuyển động ở bất kỳ vị trí nào trong nguyên tử.
D. Electron chuyển động theo các quỹ đạo hình elip.
Đáp án: B
Giải thích: Mẫu nguyên tử Bo cho rằng electron chuyển động trên các quỹ đạo dừng có bán kính xác định, chứ không phải ngẫu nhiên hay ở bất kỳ vị trí nào trong nguyên tử. Electron chỉ có thể chuyển động từ quỹ đạo này sang quỹ đạo khác khi hấp thụ hoặc phát ra năng lượng.
Câu 2: Công thức nào được dùng để tính bán kính của quỹ đạo dừng thứ n của electron trong nguyên tử Hydro?
A. \(r_n = n^2 \times r_0\)
B. \(r_n = r_0 \times n\)
C. \(r_n = \frac{r_0}{n}\)
D. \(r_n = n \times r_0^2\)
Đáp án: A
Giải thích: Trong công thức này, r_n là bán kính quỹ đạo dừng thứ n, r_0 là bán kính Bo (khoảng 5,3 * 10^-11 m).
Câu 3. Khi electron trong nguyên tử hiđrô chuyển từ quỹ đạo M sang quỹ đạo K, nguyên tử sẽ phát ra bức xạ có bước sóng nào?
A. Bước sóng ngắn nhất trong vạch quang phổ hiđrô.
B. Bước sóng dài nhất trong vạch quang phổ hiđrô.
C. Bước sóng bất kỳ trong vạch quang phổ hiđrô.
D. Không phát ra bức xạ.
Đáp án: B
Giải thích: Khi electron chuyển từ quỹ đạo có năng lượng cao sang quỹ đạo có năng lượng thấp hơn, nguyên tử sẽ phát ra bức xạ có bước sóng dài nhất trong vạch quang phổ hiđrô.
Câu 4. Năng lượng của electron trong nguyên tử hiđrô phụ thuộc vào yếu tố nào?
A. Khối lượng của electron.
B. Vị trí của electron trong nguyên tử.
C. Điện tích của hạt nhân.
D. Cả ba yếu tố trên.
Đáp án: B
Giải thích: Theo mẫu nguyên tử Bo, năng lượng của electron trong nguyên tử hiđrô chỉ phụ thuộc vào vị trí của electron trong nguyên tử, cụ thể là quỹ đạo dừng mà nó đang chuyển động.
Câu 5. Khi electron trong nguyên tử hiđrô hấp thụ năng lượng, nó sẽ chuyển từ trạng thái nào sang trạng thái nào?
A. Trạng thái kích thích sang trạng thái cơ bản.
B. Trạng thái cơ bản sang trạng thái kích thích.
C. Trạng thái dừng có năng lượng thấp sang trạng thái dừng có năng lượng cao.
D. Trạng thái dừng có năng lượng cao sang trạng thái dừng có năng lượng thấp.
Đáp án: B
Giải thích: Khi electron hấp thụ năng lượng, nó sẽ chuyển từ trạng thái có năng lượng thấp (trạng thái cơ bản) sang trạng thái có năng lượng cao (trạng thái kích thích).
Cảm ơn bạn đã cùng vatly.edu.vn khám phá mẫu nguyên tử Bo. Hy vọng bạn đã có thêm hiểu biết về cấu trúc nguyên tử và những đóng góp của nó cho khoa học hiện đại. Hãy tiếp tục theo dõi chúng tôi để cập nhật thêm nhiều kiến thức vật lý thú vị và hữu ích. Nếu có bất kỳ câu hỏi hoặc phản hồi, xin hãy để lại bình luận dưới bài viết. Hẹn gặp lại bạn trong những bài viết tiếp theo!
Bài Viết Liên Quan
Tôi là Kiều Anh, đam mê khám phá và chia sẻ những kiến thức vật lý thú vị từ cuộc sống hằng ngày đến bài học trên lớp. Với cách viết sinh động và dễ hiểu, tôi mong muốn giúp độc giả thấy được vẻ đẹp của vật lý trong mọi khía cạnh của cuộc sống. Hy vọng những bài viết của tôi trên vatly.edu.vn sẽ truyền cảm hứng và làm giàu thêm kiến thức cho mọi người.