Tìm hiểu cấu trúc nguyên tử: Từ cơ bản đến nâng cao
Điều gì làm nên nguyên tử? Tại sao chúng lại quan trọng đến vậy? Hãy cùng chúng tôi khám phá những bí mật của nguyên tử và hiểu rõ hơn về thế giới vật lý, nơi mọi hiện tượng tự nhiên đều bắt nguồn từ những hạt nhỏ bé này.
Trong hành trình khám phá thế giới vật lý, nguyên tử luôn là một đề tài nghiên cứu hấp dẫn và không ngừng được cập nhật với những thông tin mới mẻ. Tại vatly.edu.vn, chúng tôi cung cấp một cái nhìn sâu sắc và toàn diện về nguyên tử – từ cấu trúc cơ bản đến vai trò và ứng dụng của nó trong công nghệ và khoa học hiện đại.
Điều gì làm nên nguyên tử? Tại sao chúng lại quan trọng đến vậy? Hãy cùng chúng tôi khám phá những bí mật của nguyên tử và hiểu rõ hơn về thế giới vật lý, nơi mọi hiện tượng tự nhiên đều bắt nguồn từ những hạt nhỏ bé này.
Khái niệm về nguyên tử
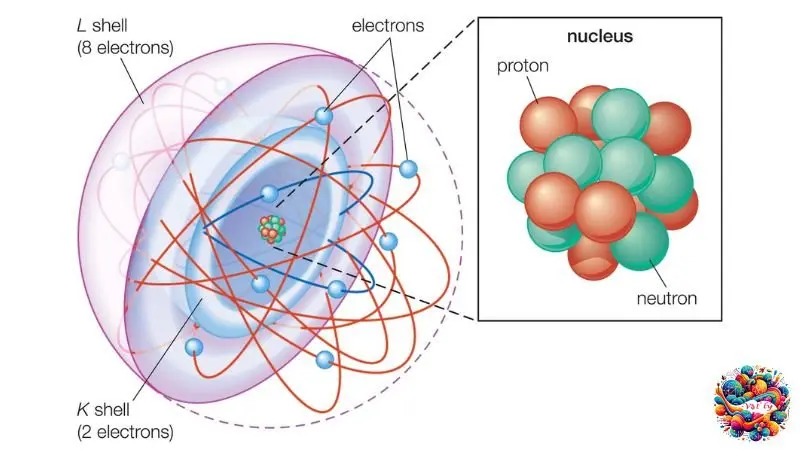
Trên thế giới tồn tại hàng chục triệu chất khác nhau, tuy nhiên chúng đều được cấu thành từ một số lượng giới hạn các nguyên tử – khoảng hơn 100 loại. Hãy tưởng tượng nguyên tử như một hạt cực kỳ nhỏ, với đường kính chỉ vào khoảng 1 angstrom, đơn vị đo siêu nhỏ tương đương 0.00000001 cm.
Trong quyển sách “Hóa học 8” được xuất bản bởi Nhà Xuất Bản Giáo Dục Việt Nam, nguyên tử được mô tả là một hạt nhỏ bé, không mang điện tích tổng cộng. Cấu trúc của nguyên tử bao gồm một hạt nhân có điện tích dương và một hoặc nhiều electron với điện tích âm xung quanh hạt nhân này.
Các electron, ký hiệu là “e”, sở hữu điện tích âm nhỏ nhất và trong các công thức khoa học, chúng thường được biểu diễn bằng một dấu trừ (-) để chỉ điện tích của chúng.
Thành phần cấu tạo của nguyên tử
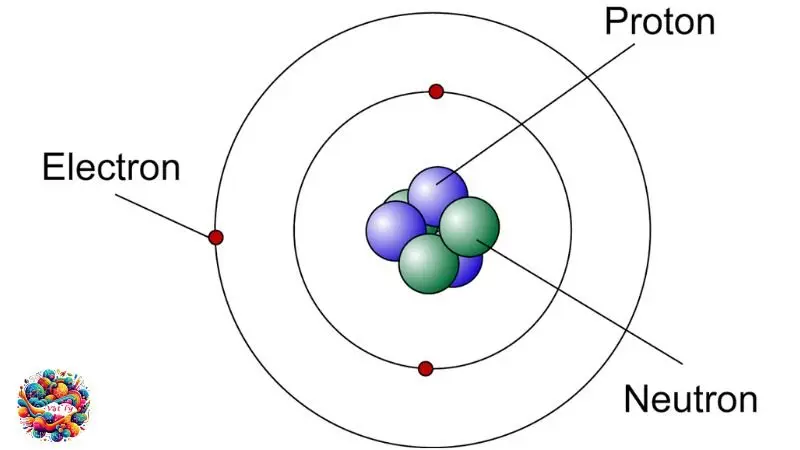
Nguyên tử là một đơn vị cơ bản của vật chất, bao gồm hai phần chính. Phần trung tâm là hạt nhân, mang điện tích dương, trong khi vỏ xung quanh hạt nhân chứa các electron, mỗi hạt mang điện tích âm. Các electron này xoay quanh hạt nhân và là thành phần chính tạo nên cấu trúc của nguyên tử.
Giới thiệu các khái niệm cơ bản về nguyên tử
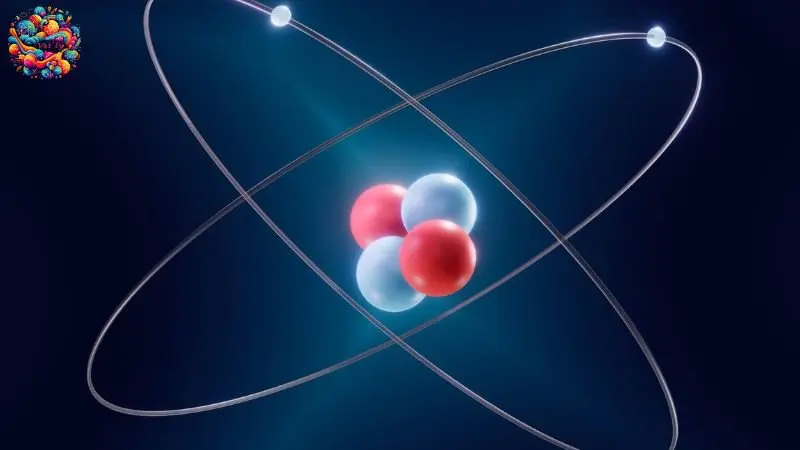
Hạt nhân nguyên tử
Trung tâm của nguyên tử là hạt nhân, chứa proton và nơtron. Proton, ký hiệu là p, mang điện tích dương, ngược lại với điện tích âm của electron. Nơtron, được ký hiệu là n, lại không mang điện tích.
Số lượng proton trong hạt nhân xác định số lượng electron trong nguyên tử, đảm bảo cân bằng điện. Về khối lượng, proton và nơtron tương đương nhau và đáng kể so với electron, vốn chỉ bằng khoảng 0.0005 lần proton. Do đó, khối lượng của nguyên tử chủ yếu nằm ở hạt nhân.
Lớp electron
Electron trong nguyên tử chuyển động nhanh quanh hạt nhân và được sắp xếp thành từng lớp. Số lượng electron trên mỗi lớp định vị trí của chúng trong cấu trúc nguyên tử. Chính nhờ electron, nguyên tử có khả năng liên kết với nguyên tử khác, tạo nên các phân tử.
Số nguyên tử
Số nguyên tử, thể hiện trên bảng tuần hoàn, đặc trưng cho số lượng proton trong hạt nhân nguyên tử của một nguyên tố. Khi nguyên tử không mang điện tích, số nguyên tử cũng bằng số electron. Điều này giúp phân biệt các nguyên tố hóa học với nhau.
Nguyên tử khối
Nguyên tử khối được định nghĩa là tổng khối lượng của một nguyên tử, tính bằng đơn vị khối lượng của carbon. Mỗi nguyên tố có nguyên tử khối riêng, biểu thị trên bảng tuần hoàn. Để thuận tiện trong tính toán và so sánh, nguyên tử khối thường được quy ước bằng 1/12 khối lượng của nguyên tử carbon.
Qua các khái niệm này, chúng ta có thể hiểu rõ hơn về cấu trúc và các đặc tính cơ bản của nguyên tử, đóng vai trò quan trọng trong nghiên cứu và ứng dụng khoa học.
Phân biệt sự giống nhau và khác nhau nguyên tử và phân tử
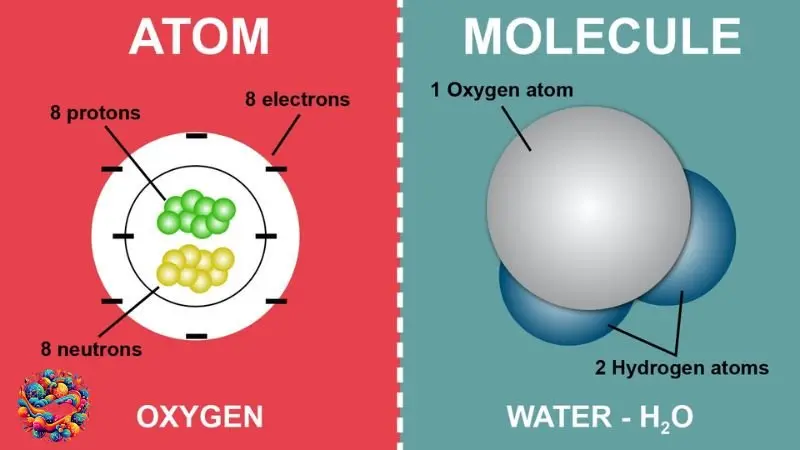
Giống nhau giữa nguyên tử và phân tử
- Cấu tạo: Cả nguyên tử và phân tử đều được cấu tạo từ các hạt cơ bản: proton, neutron và electron.
- Khối lượng: Khối lượng của nguyên tử và phân tử được tính bằng đơn vị nguyên tử u (đvC).
- Tính chất hóa học: Tính chất hóa học của nguyên tử và phân tử được quyết định bởi cấu hình electron của chúng.
Khác nhau giữa nguyên tử và phân tử
| Đặc điểm | Nguyên tử | Phân tử |
| Định nghĩa: | Nhỏ nhất, không thể phân chia được, là đại diện cho một nguyên tố hóa học. | Nhóm hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học. |
| Thành phần: | Gồm proton, neutron và electron. | Gồm các nguyên tử cùng loại hoặc khác loại. |
| Kích thước: | Nhỏ hơn nhiều so với phân tử. | Lớn hơn nguyên tử. |
| Ví dụ: | Nguyên tử oxy (O), nguyên tử sắt (Fe),… | Phân tử nước (H2O), phân tử oxy (O2),… |
| Tính chất: | Giữ nguyên tính chất hóa học của nguyên tố ban đầu. | Có thể có tính chất hóa học khác với nguyên tử ban đầu. |
Tóm lại:
- Nguyên tử: là đơn vị cấu tạo nhỏ nhất của một nguyên tố hóa học, không thể phân chia được.
- Phân tử: là nhóm hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học.
Bài tập ứng dụng về nguyên tử có đáp án

Câu 1. Nguyên tử được cấu thành từ các hạt cơ bản nào?
A. Proton, nơtron và electron.
B. Proton và electron.
C. Nơtron và electron.
D. Proton, notron và photon.
Đáp án: A. Proton, nơtron và electron.
Câu 2. Hạt nhân nguyên tử nằm ở đâu?
A. Vỏ nguyên tử.
B. Tâm nguyên tử.
C. Vòng tròn ngoài cùng của vỏ nguyên tử.
D. Không xác định được.
Đáp án: B. Tâm nguyên tử.
Câu 3. Loại hạt nào mang điện tích dương trong nguyên tử?
A. Electron.
B. Proton.
C. Nơtron.
D. Photon.
Đáp án: B. Proton.
Câu 4. Loại hạt nào không mang điện tích trong nguyên tử?
A. Electron.
B. Proton.
C. Nơtron.
D. Photon.
Đáp án: C. Nơtron.
Câu 5. Ký hiệu hóa học của nguyên tử gồm những phần nào?
A. Số hiệu nguyên tử (Z).
B. Số khối (A).
C. Ký hiệu nguyên tố.
D. Tất cả các đáp án trên.
Đáp án: D. Tất cả các đáp án trên.
Câu 6. Số hiệu nguyên tử (Z) biểu thị điều gì?
A. Số proton trong hạt nhân nguyên tử.
B. Số nơtron trong hạt nhân nguyên tử.
C. Số electron trong nguyên tử.
D. Tổng số proton và nơtron trong hạt nhân nguyên tử.
Đáp án: A. Số proton trong hạt nhân nguyên tử.
Câu 7. Số khối (A) biểu thị điều gì?
A. Số proton trong hạt nhân nguyên tử.
B. Số nơtron trong hạt nhân nguyên tử.
C. Tổng số proton và nơtron trong hạt nhân nguyên tử.
D. Số electron trong nguyên tử.
Đáp án: C. Tổng số proton và nơtron trong hạt nhân nguyên tử.
Câu 8. Nguyên tử có cùng số hiệu nguyên tử (Z) nhưng khác nhau về số khối (A) được gọi là gì?
A. Đồng vị.
B. Nguyên tố hóa học.
C. Hợp chất.
D. Phân tử.
Đáp án: A. Đồng vị.
Câu 9. Nguyên tử trung hòa về điện có tổng điện tích dương bằng tổng điện tích âm. Hạt nào mang điện tích âm trong nguyên tử?
A. Proton.
B. Nơtron.
C. Electron.
D. Photon.
Đáp án: C. Electron.
Câu 10. Khối lượng nguyên tử gần bằng khối lượng của hạt nhân nguyên tử vì:
A. Khối lượng electron rất nhỏ so với khối lượng proton và nơtron.
B. Số lượng electron trong nguyên tử rất lớn.
C. Proton và nơtron có cùng khối lượng.
D. Hạt nhân nguyên tử nằm ở tâm nguyên tử.
Đáp án: A. Khối lượng electron rất nhỏ so với khối lượng proton và nơtron.
Chúng ta đã cùng nhau đi qua một hành trình thú vị, khám phá những điều kỳ diệu của nguyên tử và vai trò của nó trong vật lý cũng như trong cuộc sống hàng ngày. Nguyên tử không chỉ là nền tảng của vật chất mà còn là chìa khóa mở ra những cánh cửa mới cho các ứng dụng công nghệ tiên tiến.
Tại vatly.edu.vn, chúng tôi cam kết tiếp tục cung cấp thông tin chính xác, cập nhật để bạn có thể tiếp tục hành trình khám phá khoa học với niềm tin và kiến thức vững chắc. Hãy theo dõi chúng tôi để không bỏ lỡ bất kỳ cập nhật nào về thế giới kỳ thú của nguyên tử và nhiều chủ đề vật lý khác!
Bài Viết Liên Quan
Tôi là Kiều Anh, đam mê khám phá và chia sẻ những kiến thức vật lý thú vị từ cuộc sống hằng ngày đến bài học trên lớp. Với cách viết sinh động và dễ hiểu, tôi mong muốn giúp độc giả thấy được vẻ đẹp của vật lý trong mọi khía cạnh của cuộc sống. Hy vọng những bài viết của tôi trên vatly.edu.vn sẽ truyền cảm hứng và làm giàu thêm kiến thức cho mọi người.
![[Vật lý 7] Nhận biết ánh sáng - Nguồn sáng và vật sáng trong](https://vatly.edu.vn/upload/526x395/2024/07/vat-ly-7-nhan-biet-anh-sang-nguon-sang-va-vat-sang-trong-526x395.webp)